Ozeanversauerung
Engl. „ocean acidification“; im dt. auch als „Versauerung der Meere“ geläufiger Begriff für die Abnahme des pH-Wertes des Meerwassers. Verursacht wird die Ozeanversauerung durch die Aufnahme von Kohlenstoffdioxid (CO2) aus der Erdatmosphäre. Der Vorgang zählt neben der globalen Erwärmung zu den Hauptfolgen der menschlichen Emissionen des Treibhausgases Kohlenstoffdioxid. Während Kohlenstoffdioxid in der Erdatmosphäre physikalisch zu steigenden Temperaturen auf der Erde führt, wirkt es im Meerwasser chemisch. Die Versauerung durch Gase lässt sich ausschließlich auf CO2 zurückführen, die Emissionen anderer Treibhausgase wie Methan oder Lachgas tragen nicht dazu bei. Darüber hinaus spielen Säureeinträge wie Dünnsäure und andere Umweltverschmutzungen eine gewisse Rolle.
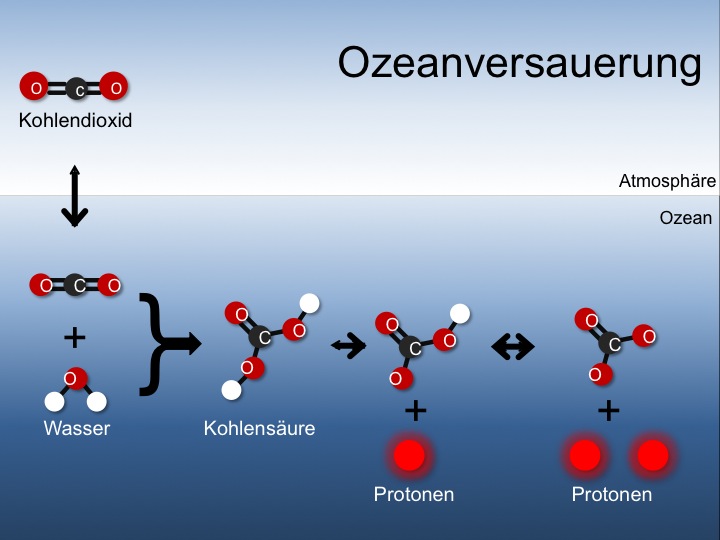 | Ozeanversauerung Dadurch dass immer ein Konzentrationsausgleich zwischen Atmosphäre und Ozean stattfindet, führen Steigerungen des CO2-Gehalts der Luft zu Steigerungen im Kohlendioxid-Gehalt des Oberflächenwassers. Das gelöste Kohlendioxid reagiert mit dem Wasser und verwandelt sich in Kohlensäure. Diese Kohlensäure kann Wasserstoffionen, sogenannte Protonen, hier rot, abgeben. Diese machen das Seewasser saurer. Quelle: AWI |
Die Folgen dieser Versauerung betreffen zunächst kalkskelettbildende Lebewesen, deren Fähigkeit, sich Schutzhüllen bzw. Innenskelette zu bilden, bei sinkendem pH-Wert nachlässt. Weil diese Arten oft die Basis der Nahrungsketten in den Ozeanen bilden, können sich daraus weitere schwerwiegende Konsequenzen für die zahlreichen von ihnen abhängigen Meeresbewohner und in der Folge auch für die auf diese angewiesenen Menschen ergeben.
Das Meerwasser ist mit einem pH-Wert um 8 leicht basisch. Nach einer Zusammenfassung der britischen Royal Society weist das Oberflächenwasser der Meere heute bis in eine Tiefe von 50 m typischerweise pH-Werte zwischen 7,9 und 8,25 auf, mit einem Durchschnittswert von 8,08. Die wichtigsten Ursachen für diese Differenz um 0,25 Einheiten sind die Temperatur des Wassers, der lokale Auftrieb von kohlenstoffdioxidreichem Tiefenwasser, sowie die biologische Produktivität, die dort, wo sie hoch ist, in Form von Meereslebewesen viel Kohlenstoffdioxid bindet und in tiefere Wasserschichten transportiert.
Eine Möglichkeit, frühere pH-Werte zu rekonstruieren, bietet die Analyse von Sedimenten. Aus der isotopischen Zusammensetzung von Borhydroxiden lässt sich bestimmen, dass der pH-Wert an der Meeresoberfläche vor etwa 21 Millionen Jahren etwa 7,4 ±0,2 betrug, bis er vor ungefähr 7,5 Millionen Jahren auf den Wert von 8,2 ±0,2 stieg. Da der pH-Wert der Meere über den Henry-Koeffizienten direkt mit der Kohlenstoffdioxidkonzentration der Atmosphäre gekoppelt ist, lassen sich so auch Paläo-CO2-Konzentrationen bestimmen. Bis zum Beginn der ozeanischen Versauerung infolge der einsetzenden Industrialisierung im 18. Jahrhundert und des steigenden Kohlenstoffdioxidausstoßes blieb dieser Wert in etwa konstant.
| Entwicklung der pH-Werte der Ozeane Im Vergleich zu den in der oberen Grafik gezeigten vorindustriellen Werten beträgt der prognostizierte Anstieg des Säuregehalts der Ozeane bis 2100 etwa 170 %, wenn die hohen CO2-Emissionen anhalten.
Der durchschnittliche pH-Wert der Meeresoberflächengewässer ist seit Beginn der industriellen Revolution um etwa 0,1 Einheiten von 8,2 auf 8,1 gesunken. Dies entspricht einer Zunahme des Säuregehalts um 26 %. Quelle: IGBP |
Die Ozeane spielen im Kohlenstoffkreislauf der Erde als Kohlenstoffsenke eine wichtige Rolle, da 70 % der Erdoberfläche von Wasser bedeckt sind. In der gesamten Hydrosphäre sind schätzungsweise 38.000 Gigatonnen (Gt) Kohlenstoff gespeichert. Das Kohlenstoffdioxid gelangt aufgrund der Differenz im CO2-Partialdruck in den Ozean. Ein Gas strömt immer vom Bereich des höheren Partialdruckes (Atmosphäre) in den Bereich des niedrigeren Drucks (Ozean).
Kohlenstoffdioxid wird so lange im Meer gelöst, bis der Partialdruck in der Atmosphäre und im Meer gleich ist. Umgekehrt entweicht es auch wieder, wenn der Druck in der Atmosphäre geringer als im Meer ist. Die Temperatur eines Meeres beeinflusst ebenfalls die Aufnahme von Kohlenstoffdioxid, da Wasser bei steigender Temperatur weniger Kohlenstoffdioxid aufnehmen kann.
Der aus der Atmosphäre aufgenommene Kohlenstoff verteilt sich im Ozean innerhalb einiger weniger Jahre in der von der Sonne durchleuchteten Schicht des Meeres. Um in noch größere Tiefen zu gelangen, gibt es zwei Mechanismen. Am wichtigsten ist die so genannte physikalische Kohlenstoffpumpe, wobei sich das kohlenstoffreiche Oberflächenwasser in der Arktis abkühlt und schwerer wird, absinkt und über die kalte Tiefenströmung des Globalen Förderbandes weiträumig in den Tiefen der Ozeane verteilt wird. Weniger wichtig, aber dennoch nicht unbedeutend, ist die sogenannte biologische Kohlenstoffpumpe, bei der Kohlenstoff als Meeresschnee (biogener Teilchenregen) in tiefere Regionen absinkt. Es dauert hunderte bis tausende von Jahren, bis das aus der Atmosphäre aufgenommene anthropogene CO2 von den Ozeanen in die tiefsten Wasserschichten vorgedrungen und verteilt ist, heute ist es bis in eine Wassertiefe von durchschnittlich 1.000 m nachweisbar.
| | Ausschnitt aus der Infografik Die Infografik befindet sich in dem Bericht: Ocean Acidification Summary for Policymakers – Third Symposium on the Ocean in a High-CO2 World Quelle: UNESCO IOC |
Bei marinen Lebewesen, die dem Meerwasser mit erhöhtem CO2-Gehalt ausgesetzt sind, spielt sich ein Prozess ab, der der Lösung von CO2 im Ozean sehr ähnlich ist. CO2 kann als Gas ungehindert durch Zellmembranen wandern und verändert so den pH-Wert der Körperzellen und des Blutes. Die Veränderung des natürlichen Säure-Base-Haushalts muss vom Organismus kompensiert werden, was manchen Tierarten besser und anderen schlechter gelingt. Eine dauerhafte Verschiebung der Säure-Base-Parameter innerhalb eines Organismus kann das Wachstum oder die Fortpflanzungsfähigkeit beeinträchtigen und so im schlimmsten Fall das Überleben einer Art gefährden.
Die Lösung von Kohlenstoffdioxid bremst zwar die Erderwärmung, die daraus folgende langsame Versauerung der Ozeane kann aber schwerwiegende Folgen unter anderem für Tiere mit einem Schutzmantel aus Calciumcarbonat (Kalk) nach sich ziehen. Wie oben beschrieben, verschiebt sich das chemische Gleichgewicht der Ozeane zu Lasten der Carbonat-Ionen. Deren Verbindung mit Calcium im Meerwasser zu Calciumcarbonat ist jedoch von vitaler Bedeutung für Kalkschalen bildende Meereslebewesen. Ein saurer werdender Ozean behindert die Biomineralisation von Korallen sowie von Kleinstlebewesen wie winzigen Meeresschnecken und Zooplankton, obwohl einige dieser Lebewesen den pH-Wert des Wassers gezielt erhöhen, indem sie die gelöste Menge an Kohlenstoffdioxid bei der Erzeugung der Kalkkristalle in den eigenen Zellen verringern.
Korallen produzieren mit Aragonit die neben Calcit am häufigsten vorkommende Kalkform im Meer. Aragonit ist eine besonders leicht durch Kohlensäure lösbare Form von Kalk, was das Risiko für die Korallen durch saurer werdende Ozeane erhöht.
| | Ausschnitt aus der Infografik Die Infografik befindet sich in dem Bericht: Ocean Acidification Summary for Policymakers – Third Symposium on the Ocean in a High-CO2 World
Quelle: UNESCO IOC |
Weitere Informationen:
- Ozeanversauerung (AWI)
- Ozeanversauerung - World Ocean Review 1 (maribus)
- Ozean der Zukunft (CAU Kiel)
- Versauerung. In: Welt im Wandel - Menschheitserbe Meer (WBGU 2013, Kap. 4.4.2 Versauerung S. 190)
- Ocean Acidification, Summary for Policymakers – Third Symposium on the Ocean in a High-CO2 World ( International Geosphere-Biosphere Programme, 2013)
- CO2-Eintrag und Versauerung. In: Welt im Wandel - Menschheitserbe Meer (Wissenschaftlicher Beirat der Bundesregierung Globale Umweltveränderungen, 2013)
- Understanding the Threats of Ocean Acidification to Coral Reefs (Edmunds, Peter J. / Carpenter, Robert C. / Comeau, Steeve, 2013)
- Ozeanversauerung - Zusammenfassung für Entscheidungsträger, Third Symposium on the Ocean in a High-CO2 World (BioAcid / Geomar)
- 20 Facts about Ocean Acidification (WHOI, 2013)
